以靶找药:利用BLI生物膜干涉技术进行基于靶点的药物筛选
利用 BLI 生物膜干涉技术,将靶蛋白固化在探头(传感器)上,钓取混合提取物、化合物库中可以结合靶点蛋白的成分,并将结合的活性成分洗脱,用质谱进行分析鉴定筛选与靶蛋白结合的药物。本文分享了两个利用BLI 生物膜干涉技术以靶寻药的不同的案例(Bio-Layer Interferometry,BLI)生物膜干涉技术是一项可以测定生物分子间亲和力的技术,仪器通过发射白光到传感器表面并收集反射光,不同频率的反射光谱受到生物传感器的光膜层厚度的影响并形成干涉。因此,结合到传感器表面的分子一旦有厚度的改变,仪器便会实时地检测到干涉光谱的位移,而这种位移可直接反应出传感器表面生物膜的厚度及密度变化,从而对待测分子间的相互作用过程进行精确的定量测定。通过对分子结合过程的实时监测,系统会测定结合常数(ka或kon)和解离常数(kd或koff),以及起始结合速率,并通过拟合计算分析得到亲和力(KD)和浓度信息(图1)。
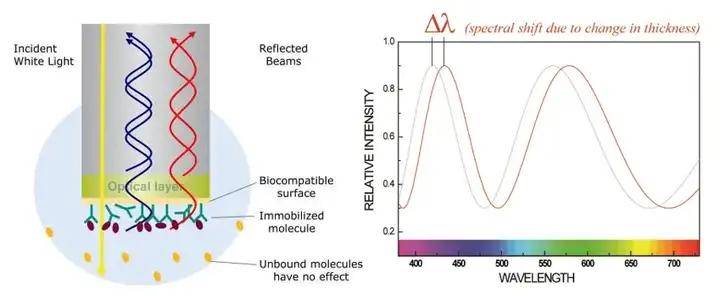 图1 生物膜干涉技术 (BLI) 原理
图1 生物膜干涉技术 (BLI) 原理
案例一 基于生物膜干涉技术(BLI)的垂钓天然产物中的活性成分
2022年,西南医科大学吴安国团队发表了High-throughput screening for amyloid-β binding natural small-molecules based on the combinational use of biolayer interferometry and UHPLC−DAD-Q/TOF-MS/MS研究论文。作者基于生物膜干涉技术(Biolayer interferometry, BLI)和 UHPLC-DAD-Q/TOF-MS/MS 联用技术,建立了从天然药物中筛选Aβ纤维抑制剂的高通量筛选方法,即将Aβ 结合在生物膜干涉仪器的传感器上,使药物提取液与传感器上的 Aβ 进行结合并解离,对收集到的解离液通过高分辨质谱进行分析并鉴定。
在此前的研究中,该团队曾通过 UHPLC-DAD-Q/TOF-MS/MS 分析确定了黄芩苷和黄芩素是黄芩中 Aβ 肽纤维的潜在抑制剂。首先作者通过该方法对黄芩(SB)进行了分析,验证了该方法的可行性(图2),BLI 结果证明黄芩与 Aβ1-42肽纤维能够结合,亲和力为199 μM。
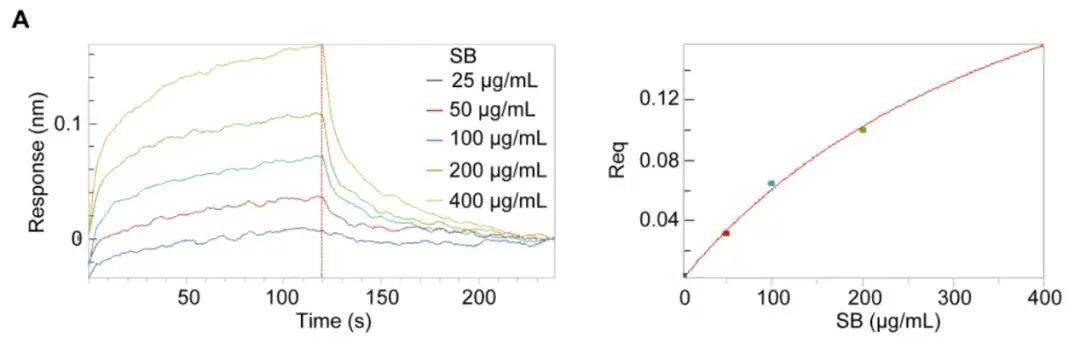
 图2 生物膜干涉技术干涉技术验证黄芩与 Aβ1-42肽纤维的结合能力
图2 生物膜干涉技术干涉技术验证黄芩与 Aβ1-42肽纤维的结合能力
为了进一步检验该方法在更复杂体系中的应用,作者利用其对经典配方开心散(KXS)进行了筛选。结果表明,开心散能够与 Aβ1-42 有直接的相互作用,亲和力为170 μM。
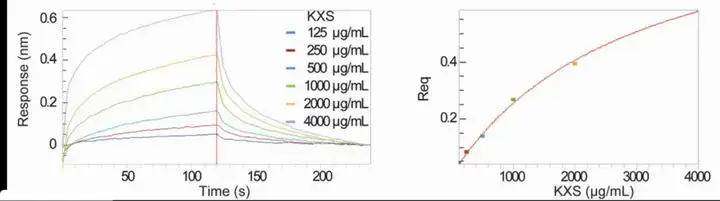
 图3 生物膜干涉技术干涉技术验证开心散与 Aβ1-42肽纤维的结合能力
图3 生物膜干涉技术干涉技术验证开心散与 Aβ1-42肽纤维的结合能力
接着,作者将 Aβ1-42肽纤维固化结合在生物膜干涉仪器的传感器上,Aβ1-42肽纤维作为诱饵,钓出开心散(KXS)提取液与传感器上的 Aβ1-42肽纤维中结合的活性成分,对收集到的活性成分通过高分辨质谱进行分析并鉴定。作者通过生物活性验证等实验,从开心散中鉴定活性成分中:猪苓酸C(PPAC)、去氢土莫酸(DTA) 和土莫酸(TA),这3个化合物与对 Aβ1-42纤维形成的抑制作用。在此基础上,作者结合分子对接与 BLI 生物膜干涉技术验证化合物与 Aβ1-42 的结合亲和力。结果表明,在开心散所筛选的化合物中,猪苓酸C、去氢土莫酸和土莫酸与 Aβ 的结合力最强(图4)。可能参与了开心散对阿尔茨海默病(AD)的神经保护作用。
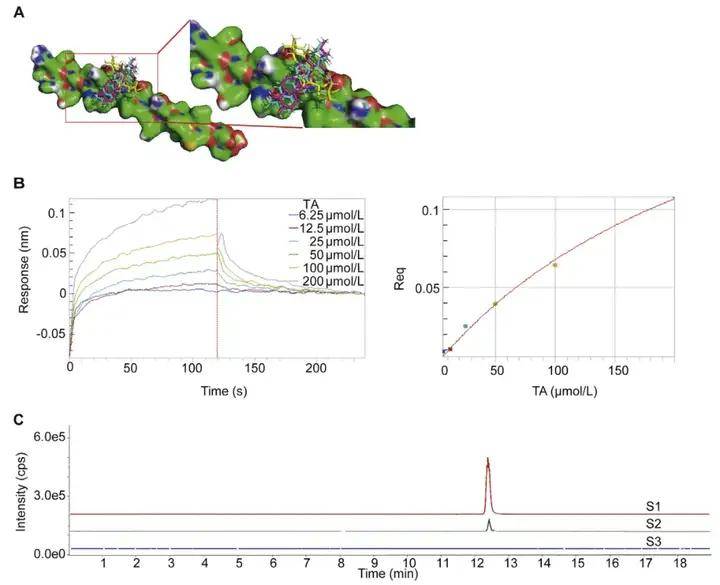 图4 猪苓酸C、去氢土莫酸和土莫酸与 Aβ1-42 的结合
图4 猪苓酸C、去氢土莫酸和土莫酸与 Aβ1-42 的结合
BLI analysis
The preparation of biotinylated Aβ1–42 and the BLI analysis were performed according to the reported literatures. In brief, the above generated Aβ1–42 peptide film was dissolved in PBS to make a concentration of 25μg/mL, which was subjected to the biotinylation with EZ-Link NHS-LC-LC-Biotin. After pre-wetting the SA biosensor with PBS to record the baseline, the biotinylated Aβ1–42 in 96-well black F-bottom plates (655209, Greiner, Germany) were directly immobilized on the SA biosensor. The extract of natural medicines or single compounds were diluted by PBS (containing 15% DMSO and 0.02% Tween 20) to the appropriate concentrations with the final volume of 200 μL per well. At the same time, an equal volume of PBS (containing 15% DMSO and 0.02% Tween 20) was added to wells and set as the control group. A total of 4 major steps, including loading for 300 s, baseline for 60 s, association for 120 s, and dissociation for 120 s, are repeated circularly. The data were acquired and analyzed by ForteBio Octet® Data Acquisition and Data Analysis software (Port Washington, NY, USA).
案例二 BLI 生物膜干涉技术在多肽库中筛选出了高亲和力结合靶点蛋白的多肽
肽类药物对比小分子化合物和大分子生物药,具有疗效好、安全性好、耐受性好、免疫原性低、特异性好等优势。传统的亲和选择方法通量低、耗时长、灵敏度低,因此本文的研究人员通过 BLI 技术与 MS 联用,建立了从多肽库中快速筛选出可与靶点蛋白结合的高亲和力多肽的方法。
01 用 BLI 生物膜干涉技术钓取多肽库的技术路线(图5)
将目的蛋白固化在 SA 传感器上,然后用BLI 生物膜干涉技术钓取多肽库中的可以结合目的蛋白的多肽,接着将多肽洗脱,再用质谱进行分析。最后,用BLI 生物膜干涉技术检测鉴定的多肽与目的蛋白的结合。
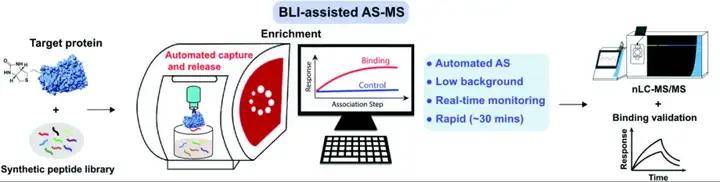 图5 BLI 生物膜干涉技术钓取多肽库的技术路线
图5 BLI 生物膜干涉技术钓取多肽库的技术路线
02 BLI 生物膜干涉技术钓取多肽库的特异性验证
作者先用一个抗体 12ca5 钓取已知的可以结合的纯化多肽,以固化 ACE2 的传感器为对照,发现多肽在较低浓度(1 nM)就可以鉴定出来。同时 ACE2 对照没有多肽被鉴定出来。说明BLI 生物膜干涉技术钓取多肽方法的特异性。
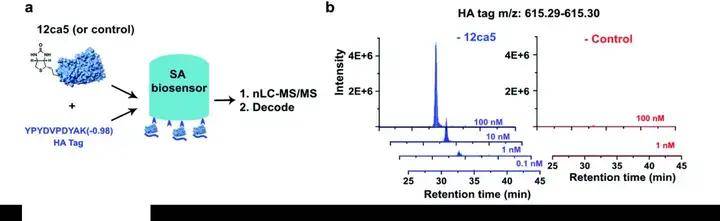 图6 BLI 生物膜干涉技术钓取多肽方法的特异性验证
图6 BLI 生物膜干涉技术钓取多肽方法的特异性验证
然后依旧用 12ca5 钓取含有10^6,10^7,10^8的多肽库(多肽理论浓度分别为1 nM, 0.1 nM, 0.01 nM),用 MS 鉴定后发现10^6,10^7多肽库可以钓取出特异性结合的多肽 (图7)。即100 pM的多肽浓度条件下,依然可以高效地特异性地把靶点蛋白识别并垂钓出来。这显示了 BLI 技术的极高灵敏度。

图7 a 将抗体12ca5固化在SA传感器上,在10^6,10^7多肽库可以钓取含有特征序列的结合抗体的多肽
b 垂钓出的多肽有与抗体结合的特征序列
参考文献
[1] Guo, Minsong, et al. "High-throughput screening for amyloid-β binding natural small-molecules based on the combinational use of biolayer interferometry and UHPLC− DAD-Q/TOF-MS/MS." Acta Pharmaceutica Sinica B 12.4 (2022): 1723-1739.
[2] Zhang, Genwei, et al. "Automated affinity selection for rapid discovery of peptide binders." Chemical Science 12.32 (2021): 10817-10824.,












